Inmunidad cruzada, e itraconazol: posibles soluciones precautorias desde el modelo una salud contra el coronavirus pandémico (covid-19)
Ricardo Andrés Roa-Castellanos
Ricardo Andrés Roa-Castellanos

La actual pandemia causada por el Coronavirus-19 al momento de escribir este documento, no cuenta con una vacuna específica de la actual cepa-problema, ni tratamientos puntuales, que permitan construir -bajo el actual convencionalismo- una prevención inmune del tipo “Inmunidad de rebaño” a nivel de las naciones en particular, o para el rango mundial desde una visión general.
~10.000 muertos y ~240.000 infectados en las distintas latitudes, tras un par de meses desde el inicio del brote pandémico[1], obligan a acciones certeras más pronunciadas de disminución del riesgo. Para marzo 19, las noticias reseñaron en Italia 3.400 muertos en total y 475 decesos en las anteriores 24 horas italianas a causa de la infección[2].
Al tiempo, si bien fármacos anti-virales han mostrado resultados alentadores al controlar cuadros sintomatológicos[3], lo cierto es que, el virus puede propagarse desde estos pacientes recuperados por varios días y, dados los costos, rapidez, y magnitud del creciente episodio infecto-contagioso por el novel Coronavirus-19 (Covid-19), la implementación de su uso a nivel poblacional dejaría un enorme contingente de población en condición vulnerable a la enfermedad y la muerte.
Aunque hay promesas de vacunas en curso para esta infección (4 junto a 30 medicamentos en vía de investigación y desarrollo)[4], el caos institucional, el nivel de los contagios y número de muertes diarias[5], junto a la globalización de una sociedad irrespetuosa con las normas sanitarias y el derecho a la vida, tales situaciones determinan -preferiblemente- un enfoque no-convencional, un tipo de reacción inmediata y efectiva, con las herramientas científicas existentes en la actualidad, contra el amenazante evento.
Ante los anuncios populares de vacunas contra el Covid-19, es preocupante que a nivel científico un Ensayo Clínico para vacunas, de forma estándar, dura normativamente en su Primera Fase (I) de Seguridad e Inmunogenicidad, de 9 a 18 meses. La Segunda Fase (II) o de Establecimiento de rango de dosis, tarda 2 años. La Tercera Fase (III), al ser la Aplicación experimental masiva dura varios años[6], con 10.000 a 50.000 individuos experimentales, lo cual suma la demora -de meses- para reclutar tal cantidad de individuos, y se adiciona en tiempo, a que el parámetro de seguimiento debe prolongarse por 2 a 3 años, de acuerdo con la OMS, hasta tener total aprobación lo cual lleva los tiempos al absurdo mientras centenares de gentes están muriendo asfixiadas en este mismo instante en que escribo[7]. No hay tanto tiempo, ni poder institucional o económico, para resistir tanto tiempo a futuro en pruebas inciertas.
Con base en lo anterior, puede decirse que las mediáticas noticias sobre el país generador de la epidemia, China, cuyas autoridades dicen ya contar con una “vacuna exitosa”[8], o son directamente un timo gubernamental -o de ser cierta esa información-, la misma sugiere que la epidemia y la vacuna venían siendo trabajadas de mucho tiempo atrás. El factor tiempo, en todo caso, revela que deben instaurarse nuevas acciones en pro de la supervivencia. La Bioética, elemento transversal de este escrito, fue definida como la Ciencia de la Supervivencia por su padre estadounidense, V.R. Potter.
Si bien existen prometedoras opciones de generar vacunas puntuales, lo cierto es que estas clases de promesas se han dado también para la Malaria desde inicio del Siglo XX, o para el SIDA, desde 1996[9], sin que para 2020 exista ninguna de ellas, en la realidad, con el necesario éxito poblacional masivo.
PRINCIPIO DE PRECAUCIÓN: DE LAS DEFINICIONES A LA PRÁCTICA
Bajo esta luz, los enfoques precautorios, que configuran el llamado Principio de Responsabilidad (PR), utilizan los datos de la ciencia desde una perspectiva académica, con enfoque institucional, dirigido a la solución práctica de problemas (PR Activo) y prevención de los mismos (PR Pasivo).
Por tanto, intrínsecamente, apelar al PR connota un razonamiento comprobado, validado y educado, guiado por la solidez del método científico, pero a la vez incorpora, de forma explícita, caracteres que se saben indeterminados en la toma de decisiones para una situación problema (Riechmann & Tickner, 2002).
Desde una perspectiva jurídica, dado el comportamiento estocástico de la realidad ambiental y de la Salud Pública, el principio de precaución se convierte en la posibilidad de reacción científica, tan prudente como estructurada, más aconsejable en urgencias vitales. Está basado en 5 virtudes (Responsabilidad, Respeto, Prevención, Obligación de saber e informar sin escudarse en la ignorancia [Idoneidad de acción], y Obligación de compartir el poder científico-técnico [gregarismo en la toma de decisiones basado en la ciencia y la tecnología][10].
Estas 5 virtudes deben acompañarse de 7 principios conceptuales (1. Anticipación preventiva para la acción, 2. Aceptación de posibles márgenes de error, 3. Proporcionalidad de la respuesta en la relación costo – beneficio, 4. Carga de la prueba para quien proponga la solución ante la falta de alternativas, 5. Búsqueda implícita de la mayor certidumbre, 6. Apertura pública en los procesos, 7. Construcción de soluciones alternativas tendiente a la minimización del riesgo y efectos negativos problémicos)[11].
Contrario a lo que se ha visto últimamente, con la parametrización descrita, el Principio de Precaución es un principio activo a favor de la ciencia y no una cadena restrictiva para los desarrollos científicos y sus iniciativas.
A la luz de esta certeza transdiciplinaria, especialmente pertinente para las situaciones caóticas en las Ciencias Ambientales y la Salud Pública, procedo a sugerir, como Virólogo titulado, unas alternativas de solución fundamentadas en razonamientos científicos probados para un marco conceptual integral, pertinente, basado en el modelo Una Salud (combinación ejecutiva de análisis y soluciones para bien simultaneo de la Salud Humana, Animal y Ambiental), ante un panorama problémico que no cuenta con soluciones específicas de prevención inmune como ocurre con la ya denominada “Pandemia por el Coronavirus-19” acorde con la OMS[12].
En mayo de 1796, Edward Jenner, médico rural de Edimburgo procede a inmunizar al niño de 8 años, James Phipps, al no contar la humanidad con otra solución contra una pandemia ahora erradicada: la Viruela humana.
El contexto epidémico de la Viruela humana, enfermedad que en aquel entonces también permanecía sin solución, siendo ocasionada por una infección viral (virus de Variola major y minor, en inglés denominada Smallpox, y en español conocida como la famosa y letal Viruela), producía la muerte del 20% de los afectados y llegaba a contagiar el 60% de la población de la Gran Bretaña.
Ello recuerda las recientes cifras de infectividad proyectadas para el Coronavirus-19 por Marc Lipsitch, salubrista de Harvard[13], contempladas también por la mandataria alemana, Angela Merkel, basada a su vez en Lothar Wieler, presidente del Instituto Robert Koch: Esto es que, con las actuales circunstancias, un 60% de la población global puede contagiarse[14].
Respectivamente la tasa de mortalidad global, bajo las actuales circunstancias, fluctúa según diversos cálculos entre 1 a 3.4%[15]. Esto se traduciría en que, de forma inaparente, subclínica o clínica, ~4.500 millones de personas podrían llegar a infectarse, y de estos, la cifra de muertos oscilaría entre 153 a 45 millones de personas al considerar la estadística de casos confirmados reseñados por la Organización Mundial de la Salud[16].
Pero regresando al primer tipo Jenneriano de inmunización, este icónico primer ejemplo significa una gran cantidad de factores similares que pueden ser luces para abordar el proceso en curso, el cual -como ocurre con las pandemias- de nuevo siembra enfermedad, desesperación, y muerte, masivamente, contra la humanidad. Pero la ética científica no se lamenta. El Logos actúa contra las amenazas vitales.
El médico rural británico, Jenner, logró proteger al niño Phipps inoculando el material de una pústula de una ordeñadora que padecía una moderada enfermedad transmitida por animales, la Viruela bovina (en inglés Cowpox). Científicamente, la mujer -Sarah Nelmes- había adquirido la infección, Viruela vacuna, de su vaca Blossom que padecía pústulas en la ubre. Al acudir a Jenner, este pensó en una observación previa, según la cual las mujeres ordeñadoras que habían padecido esa leve presentación de viruela de los bovinos, no sufrían de la mortal viruela humana. A las ordeñadoras, las lesiones cutáneas pronto les pasaban y quedaban protegidas contra la infección humana[17]. Fue este un cruce de reacciones inmunitarias.
Por lo anterior, Jenner dedujo que con un ser humano no expuesto -de ahí lo joven de Phipps, hijo de su jardinero- podía comprobar a manera de “reporte de caso” estructurado que la observación empírica podía demostrarse científicamente.
El niño Phipps pese a quedar expuesto a la infección humana, luego, no se contagió. Tampoco, 23 personas más, con quienes Jenner (1798) corroboró su método y que compondrían el contenido del libro “'An Inquiry into the Causes and Effects of the Variolae Vaccinae; a Disease Discovered in some of the Western Counties of England, Particularly Gloucestershire, and Known by the Name of The Cow Pox'.”[18]

Figura 1. Portada del libro de Jenner explicando la obtención de su procedimiento vacunal.
Por esta razón, en homenaje a la vaca Blossom, cuya piel se encuentra en la Universidad de San Jorge en Londres, Inglaterra, la “vacuna” o “vaccinia” para prevenir enfermedades recibe ese nombre desde el origen latino clásico (idioma de la ciencia clásica) para la palabra vaca (Lat. Vacca).

Figura 2. Portada de la Revista Universitaria Londinense “George’s” donde aparece la vaca Blossom, fijada en el recinto de la Universidad de San Jorge en Inglaterra.
En el artículo anterior, anotábamos que los virus tienden a ser específicos de especie. Cuestión demostrada también para las distintas formas de Coronavirus humanos y veterinarios[19].
Jenner, sin embargo, había intuido y aplicado un par de características, ahora científicas, orgánicas reales de la Virología e Inmunologías Comparadas entre especies:
Este segundo punto fue, precisamente, el trabajado por Louis Pasteur quien hizo pases sucesivos de la infección rábica por conejos, atenuando el respectivo virus de la familia Rhabdoviridae, es decir, quitándole al virus rábico el poder de generación de la mortal enfermedad (patogenicidad), para tratar lo que por aquel tiempo era una epidemia en Francia: la rabia en perros[20].
Al momento del accidente rábico que padeció el niño francés, Meister, Pasteur había probado que la inoculación en perros de la sustancia atenuada en sistema nervioso central de conejos, era exitosa para evitar la mortalidad y prevenir el desarrollo de la cruel enfermedad en la especie del mejor amigo del hombre (la canina). Era esta una novel inmunoterapia aún en uso para los humanos ante accidentes rábicos. Curiosamente, un niño también resultó ser el motor de estandarización de la vacuna antirrábica[21]:
Para 1885, a los nueve años de edad, Joseph Meister había sido mordido por un perro con rabia, de camino a la escuela de Meissengott (actualmente Maisonsgoutte), tras haberlo provocado con un palo. Pero Pasteur tenía por profesión el ser químico, no era médico. Si le trataba con una vacuna, sin probar suficientemente, podía ser víctima de un problema legal. Sin embargo, tras consultar con sus colegas académicos, y describir sus sustentos teórico-prácticos, bajo actitudes compatibles con el referido Principio de Precaución (Activo)[22], Pasteur se decidió a inocular con la vacuna “atenuada - concebida en y para otra especie” al muchacho.
Pasteur había sistematizado la manera de crear vacunas en laboratorio desde mucho antes, siguiendo los preceptos de Jenner, con el Cólera Aviar, el Ántrax, y después lo haría con la fiebre tifoidea. El niño Meister también así fue salvado de la mortal infección viral[23].
Por tales hechos, Jenner, es tenido hoy como Padre de la Inmunología, o ciencia que estudia los mecanismos de defensa celulares y humorales desplegados para procurar el re-equilibrio de la salud. Para nuestro interés, Jenner, y su émulo, el Padre de la Vacunación Antirrábica y de la Medicina Preventiva (Pasteur), se valieron de inoculaciones, que de forma intuitiva empleaban lo que sería definido como una potencia que ligaba la inmunología, la medicina, la virología, la veterinaria, y la ecología: la actualmente denominada Inmunidad o Protección Cruzada.
Es decir, ambos se valieron de la protección inmunoprofiláctica conferida sobre un huésped por medio de la inoculación, con una cepa atenuada o un componente de un microorganismo patógeno de otra especie, que suele prevenir la infección cuando finalmente el inmunizado es desafiado con la cepa similar de su especie.
En el relatado ejemplo de Jenner, los anticuerpos generados contra la viruela bovina, con un pase de atenuación en la ordeñadora, permitieron la vacuna efectiva contra la viruela de humanos. Comúnmente, el microorganismo que logra este efecto de inmunidad cruzada es un virus.[24]
Para el ser humano, el modelo animal de respuesta a medicinas o fármacos, incluso a medicamentos y comportamientos quirúrgicos, neurológicos[25], oncológicos[26], cardiológicos[27], o en ramas tales como la fisiología[28], la terapia génica[29], la inmunología[30], o la toxicología[31], es el perro[32].
Lo anterior no es ocasionado sólo por la experiencia de Pasteur, que se animó a extrapolar los resultados antirrábicos vistos en favor de los caninos a los seres humanos. Los canes, ciertamente, guardan una gran semejanza funcional -no igualdad absoluta- en sus respuestas orgánicas con el ser humano[33].
En Norteamérica, por ejemplo, la raza Beagle[34] ha sido el estándar como modelo animal[35] para estudios en analogía científica médica humana, tanto como en comportamientos de respuesta clínica[36] e inmunológica[37].
Es decir, la comunidad científica ha avalado, para el análisis precautorio necesario, que las respuestas orgánicas obtenidas y los logros alcanzados en perros, a nivel de investigación científica médica, suponen un muy buen estándar comparativo de rutina -bioequivalente, aceptado- en sus resultados para ensayos experimentales como modelo animal.
Fue descrito en el artículo anterior que en Medicina Veterinaria hay distintos Coronavirus que infectan de forma especie-especifica, diversas especies de animales domésticos y silvestres. También, que mientras algunos de ellos se comportaban como Zoonosis (enfermedades que los animales trasmiten a los humanos), otros de ellos han correspondido a Antropozoonosis (infecciones donde el humano contagia a los animales). En contraste, las simples Antroponosis son infecciones como el sarampión o la varicela, es decir, aquellas que no tienen reservorios animales y su transmisión suele ser interhumana[38].
El Covid-19 es una zoonosis con aceptado origen de transmisión desde animales silvestres.
En relación con lo anterior, podemos ver los elementos más esenciales en la síntesis de la Virología Comparada para los Coronavirus de importancia Veterinaria, en la siguiente tabla:
| Virus | Principal Huésped | Tipo de Enfermedad |
| Virus de la Gastroenteritis Transmisible (TGEV)A | Porcinos | Inflamación en tractos digestivo y respiratorio |
| Virus de la Peritonitis Infecciosa Felina (FIPV)A | Felinos | Digestiva, Respiratoria, Neurológica, del Feto, Oftálmica, Peritoneal. |
| Coronavirus Felino (FECV)A | Felinos | Entérica |
| Coronavirus Canino (CCV)A | Caninos | Entérica |
| Coronavirus Bovino (BCV)B | Bovinos | Entérica |
| Virus Hemoaglutinante de la Encefalomielitis Porcina (HEV) | Porcinos | Entérica, Respiratoria, Neurológica |
| Coronavirus equino (ECV)B | Équidos | Entérica |
| Coronavirus del pavo (TCV)B-3 | Aves | Entérica |
Tabla 1. Virología comparada de Coronavirus de interés Médico-Veterinario.
De acuerdo con clados de genética poblacional y rastreo evolutivo de virus, en el siglo XVIII, el coronavirus bovino (BCV) -por ejemplo- estaba ligado al humano y, los investigadores están de acuerdo en que fue entre 1890 y 1899 cuando se produjo el nacimiento del grupo que afecta a los humanos (HCoV229E, HCoVOC43 y SARS-CoV (que inducen enfermedad de vías aéreas respiratorias superiores, e inferiores, en el último caso) // en adición a HCoV-NL63, HCov-NH estos últimos emparentados con SARS-CoV y con sesgo de prevalencia infantil), pero se desconoce si este efecto fue por una separación respecto al bovino o por una mutación. A pesar de esta línea temporal, el familiar común más cercano se remonta a la década de los 50 del siglo XX. Se trata del OC43 y se encuentra estrechamente relacionado con varias especies de murciélagos, según han señalado estudios recientes. En humanos fue detectado por primera vez en los años 60, concretamente en las cavidades nasales y desde entonces han sido identificados seis nuevos miembros de esta familia, siendo el último el 2019-nCoV o coronavirus pandémico[39].
Semejanzas antigénicas han sido establecidas entre los subtipos A o 1 (TGEV, FIPV, FECV, HuCoV229E, HCoVNL63 [Enfermedad cardiaca infantil de Kawasaki] y CCV) y entre los subtipos B o 2 (BCV, HuCov-OC43, SARS-CoV, HEV). Posteriormente, en 1983 la taxonomía abrió la clasificación a 5 grupos[40]. Cada subtipo mencionado presentó reacción cruzada antigénica en laboratorio, lo cual no debe confundirse con el concepto inmunidad cruzada[41]. Posteriores subtipos fueron reclasificados serológica y filogenéticamente[42] hasta conformar 3 grupos clasificados y uno sin clasificar[43].
Es de resaltar, sin embargo, que la reacción de la inmunidad humoral (anticuerpos) es capaz de bloquear los Coronavirus, de manera cruzada, por cuanto inutiliza los peplómeros o estructuras con forma de mazo, o pétalos, que se ven cuando el coronavirus está en medio extracelular pero que desaparecen una vez entran en el citosol. Estas espículas están compuestas por tres (3) moléculas de glicoproteína (Gp) S o E2 (Figura 3). Esta Gp es muy estable a temperatura de 37 grados Celsius y hasta un pH de 8[44].
Pero lo más importante es que tiende a ser el blanco de las respuestas de inmunidad humoral neutralizante en diversas especies, la citotoxicidad mediada por células, la estructura responsable de la unión del virión a la célula, genera efectos citopáticos que producen la fusión de membranas celulares[45], pero es una estructura de conformación bastante constante en los diversos coronavirus pese a ser estos específicos de especie.
De hecho, la proteína E2 o S, es el mayor inductor de inmunidad protectora contra los coronavirus. También, conviene notar que el efecto de reacción sobre las células (citopático) es común en los distintos coronavirus no seroneutralizados (no bloqueados por anticuerpos)[46]. Por su parte, los anticuerpos inducidos por la glicoproteína (M o E1) pueden neutralizar la infectividad vírica, pero únicamente en
presencia de Complemento, como se ha demostrado para el VHM y el VGPT (Martin, 1993; Collins y col., 1982; Woods y col., 1988).
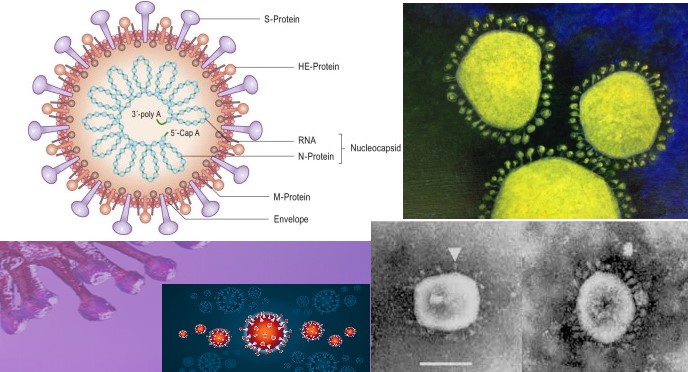
Figura 3. Representación y microfotografías electrónicas de peplómeros coronavirales.
Pero esa cualidad, recién descrita, no está restringida a los animales. Por el contrario, hace poco al inicio de la actual pandemia, esta propiedad relacionable con los peplómeros, fue comprobada científicamente en la recuperación clínica en Australia de una paciente humana (47 años, originaria de Wuhan) infectada por Covid-19.
La paciente aquejada por el cuadro clínico de la enfermedad humana (dolor de garganta, tos seca, dolor torácico pleurítico, disnea leve, fiebre), y Covid-19 diagnosticado por PCR, mostró una reacción inmunológica caracterizada por producción de células T CD4+, CD 8+, y células secretoras de anticuerpos, con respuesta de inmunidad humoral del tipo Ig M (respuesta de tipo intravascular) e Ig G (respuesta de tipo tisular) detectadas en sangre ANTES DE LA DESAPARICIÓN DE SU SINTOMATOLOGÍA CLÍNICA[47].
Las divergencias fundamentadas en reacciones serológicas a anticuerpos fluorescentes, que han servido para la clasificación taxonómica de los coronavirus humanos o animales, además, dieron pie para el exitoso desarrollo de las vacunas en Medicina Veterinaria contra dos enfermedades de interés:
Si se recuerda en el artículo anterior, la respuesta de Ig G inducida por los peplómeros (estructuras altamente conservadas evolutivamente en las cepas inter-especies) otorgan la base del éxito para la vacuna contra el coronavirus de la diarrea de los terneros, que por inmunidad pasiva natural (anticuerpos) quedan protegidos desde la madre.
En tal sentido, en una investigación de 1962, Haelterman demostró que perros y zorros podían ser infectados experimentalmente con el VGPT patológico para los porcinos. Dicho autor logró aislar el virus en las heces y detectar la presencia de anticuerpos neutralizantes, en AUSENCIA DE SINTOMATOLOGÍA CLÍNICA[48].
A su turno, la gastroenteritis canina producida por el CCV es una enfermedad infecciosa de propagación rápida. De manera parecida a Covid-19, su transmisión puede ser fecal — oral, pero su fuente primaria de contagio sí está constituida por las heces de los animales afectados ya que no injuria el sistema respiratorio en los canes.
La infección se disemina a través de la contaminación de objetos y del medio ambiente (fómites o vectores mecánicos, característica compartida con Covid-19[49]). Se ha demostrado que, en condiciones favorables, el coronavirus canino puede permanecer viable en las heces durante un periodo aproximado de 10 días[50]. Cuestión casi idéntica a los patrones de sobrevida en el ambiente del Covid-19 (9 días)[51].
La incidencia de la enfermedad se centra en los cachorros de mes y medio a 3 meses de edad, aunque también los perros adultos pueden ser receptivos a la infección. La tasa de morbilidad es variable, pero la de mortalidad es normalmente baja. Los animales infectados eliminan virus en las heces durante al menos dos semanas después del comienzo de la infección[52].
No obstante, estos dicientes estudios nos permiten dilucidar una oportunidad contra el Covid-19 y, en adición, atisbar el característico pensamiento disruptivo que la terapéutica e inmunoprofilaxis Veterinaria tiene.
En primer lugar, las vacunas para este tipo de enteritis coronavirales en el perro tienen características muy especiales.
La vacuna para el CCV se vale de la Inmunidad Cruzada de subtipo que hay entre CCV y FIPV-1 (el coronavirus del gato). Es decir, la inmunidad que el perro genera con la vacuna va dirigida contra un virus que no es de su especie y que así, no determina enfermedad alguna en él, pero le protege en adelante.
Para efectos prácticos, lo que se inocula en perros como vacuna comercial es el virus “atenuado” de los felinos (FIPV-1).
Dentro de los tres grupos de Coronavirus clasificados FIPV y TGEV poseen los peplómeros más grandes a nivel proteico (210 kd) pudiendo ser por esta razón un mayor inmunógeno con las repeticiones heptadícas de la región C terminal. Esta región es similar para los tres grandes grupos de Coronavirus, estando caracterizados estos sitios por su “Alta homología” estructural[53].
Este hallazgo para un sentido de aplicación inmunoprofiláctica contra el Covid-19 cuenta con otros respaldos. Los estudios sobre el primer SARS (hay grupos que llaman al Covid-19 en la forma SARS-CoV-2 o SARS 2), establecieron que, aunque el epidémico SARS-1 no provenía de ningún coronavirus animal, si podía ser bloqueado por los anticuerpos generados contra el Grupo 1 de coronavirus, lo cual fue pensado en su utilidad para el diagnóstico[54], pero no para un uso inmuno-terapéutico que aquí estaríamos considerando. Ahora bien, recuérdese que en el grupo 1 de Coronavirus es donde está, justamente, el inmunógeno FIPV-1[55].
En segundo lugar, el FIPV-1 (o Virus de la Peritonitis Infecciosa Felina, tipo 1, por sus siglas en inglés) además de representar la cepa global más extendida a nivel global (del 70 -90%), para esta fatal enfermedad de los gatos, nos ofrece desde la Medicina Veterinaria también la fuente de la segunda herramienta terapéutica precautoria, ahora farmacológica, contra el Covid-1.
Estamos hablando, para efectos de una Virología Comparada, de que el FIPV-1 al igual que el Dengue, el virus de la Hepatitis C, o incluso el VIH, es conformacionalmente dependiente del colesterol intracitoplasmático de las células diana de sus respectivos huéspedes[56]. Recuérdese que los viriones de Coronavirus poseen una envoltura lipídica con forma esférica y diámetro aproximado de unos 140 nm. Esta característica estructural también fue demostrada para el SARS-HCoV-1[57].
Grupos de investigación veterinaria encontraron que el compuesto U18666A fuertemente inhibía la infección por FIPV y es un inhibidor del transporte del colesterol[58].
Al no contar con ensayos clínicos, se contaba con precedentes según los cuales el agente antifúngico, Itraconazol (ICZ), con base en este mismo marco teórico se comportaría como un buen fármaco anti-viral para otra clase de infecciones virales (poliovirus, coxsackievirus, enterovirus-71, rhinovirus) al bloquear el ligando proteico del oxisterol / oxysterol (OSBP por sus siglas en inglés) [59].
Los médicos veterinarios japoneses hallaron que, efectivamente, con una dosis inicial más alta de Itraconazol, para subir los niveles plasmáticos en sangre, seguida de las dosis normales, la carga viral del Coronavirus terminaba por reducirse satisfactoriamente con recuperación clínica y que la ligera alteración de la enzima Alanino Aminotransferesa volvía a la normalidad tras acabar el tratamiento para la enfermedad multisistémica en el Felis catus.
El Itraconazol es un fármaco seguro ya aprobado para uso farmacológico en humanos. Podría usarse, este medicamento, sin peligro en humanos contra el Coronavirus a dosis normales en pacientes diagnosticados con Covid-19. No hará daño a los pacientes, pues es de uso probado, bioseguro, aconsejable contra hongos bajo posologías normales, pero si puede implicar un cerco epidemiológico para evitar la progresión de la enfermedad CORONAVIRAL empezando con los infectados, el personal médico, y los cuidadores.
Saben mis amigos de Facebook que desde el mes de enero venía advirtiendo que las fronteras debían ser cerradas dada la inusitada y alta infectividad que mostraba el Coronavirus. Hoy lamentablemente, dada la tozudez de globalistas y políticos, muchas personas inocentes han muerto.
En este momento las reacciones políticas amenazan con causar más daño y muerte que el Coronavirus mismo. El desplome de la economía y la destrucción de los sistemas institucionales de relación civilizatorios (estado, mercado, etc.), exigen que estas dos herramientas sean puestas en práctica para la contención epidemiológica.
Antes de lanzarme a sugerir por esta vía el uso de la vacuna contra el Coronavirus canino, hecha con FIPV-1 en el humano, lo probé en mí, por vía intramuscular glútea profunda, sin que me haya causado ningún efecto colateral o deletéreo cuatro semanas antes de escribir este documento. No generó ni siquiera febrícula en el autor.
En el sistema de pesos y contrapesos éticos, para un ensayo clínico donde no se tiene mucho que perder, pero si -posiblemente- vidas por salvar, el balance de ambas es que ni la inmunoterapia, ni la farmacoterapia sugeridas, hacen daño, pero ambas herramientas terapéuticas pueden representar un enorme bien para la humanidad, o si no funcionan, no significarían nada.
Según las 5 virtudes y 7 principios conceptuales del Principio de Precaución (activo), estamos ahora compelidos a la acción con estos conocimientos.
AGRADECIMIENTOS: A los científicos católicos Edward Jenner[60], Louis Pasteur -devoto practicante del rezo del Rosario-; a San Jorge de Inglaterra, y a San José, esposo de María y padre adoptivo de Nuestro Señor Jesucristo, en su día 19 de marzo de 2020, cuando termino este escrito.
[1] URL (19-03-2020): https://www.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6
[2] URL (16-03-2020): https://elpais.com/sociedad/2020-03-18/italia-registra-un-nuevo-record-con-475-fallecidos-en-24-horas.html ; https://www.dw.com/es/italia-supera-los-2000-los-muertos-con-coronavirus-con-349-m%C3%A1s-que-ayer/a-52798756?fbclid=IwAR1ylHbp9iBd1qHw2R01YS99Y7bXK_mHVc20tL8YTcmsjdzee7KthOaG0DE
[3] URL (19-03-2020): https://www.diariofarma.com/2020/03/17/oms-covid-19-puede-propagarse-a-partir-de-pacientes-ya-recuperados
[4] URL (14-03-2020): https://www.phmk.es/industria/30-medicamentos-y-cuatro-vacunas-en-desarrollo-para-el-coronavirus
[5] URL (14-03-2020): https://www.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6
[6] URL (18-03-2020): https://vacunasaep.org/sites/vacunasaep.org/files/jcav-aep2013-11.pdf
[7] URL (18-03-2020): https://www.who.int/biologicals/publications/clinical_guidelines_ecbs_2001.pdf?ua=1 [Página 27]
[8] URL (18-03-2020): https://www.clarin.com/mundo/china-anuncio-desarrollo-exito-vacuna-coronavirus-lista-ensayos-clinicos_0_gDx9X7Dz.html ; https://www.infobae.com/america/mundo/2020/03/17/china-dice-haber-desarrollado-con-exito-la-vacuna-contra-el-coronavirus-y-se-prepara-para-su-produccion-a-gran-escala/
[9] Cervantes, J & Aguilar, J. (1998). Perspectivas de la vacuna contra el VIH. Revista Médica Herediana, 9(4), 143-150. Recuperado en 17 de marzo de 2020, De: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1018-130X1998000400004&lng=es&tlng=es.
[10] Tickner, J. A., Raffensperger, C., & Myers, N. (1999). The precautionary principle in action: a handbook. Windsor, North Dakota: Science and Environmental Health Network. Lowell, MA: UMass-Lowell Publishing.
[11] Cosbey, A. (2000). A forced Evolution? The Codex Alimentarium Commission, Scientific Uncertainty and the Precautionary Principle. Winnipeg: International Institute for Sustainable Development Publishing.
[12] URL (17-03-2020): https://www.who.int/es/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020
[13] URL (16-03-2020): https://www.ondacero.es/noticias/sociedad/coronavirus-contagio-poblacion-mundial_202003095e663f231eff86000108050b.html
[14] URL (16-03-2020): https://elpais.com/sociedad/2020-03-11/merkel-cree-que-entre-el-60-y-el-70-de-la-poblacion-resultara-contagiada-por-coronavirus-si-no-se-toman-medidas.html
[15] URL (19-03-2020): https://www.latimes.com/espanol/eeuu/articulo/2020-03-07/cual-es-la-tasa-de-mortalidad-del-nuevo-coronavirus-y-por-que-sigue-cambiando
[16] URL (16-03-2020): https://ourworldindata.org/coronavirus
[17] URL (14-03-2020): https://web.archive.org/web/20090628230753/http://jennermuseum.com/sv/smallpox2.shtml
[18] URL (14-03-2020): https://collections.nlm.nih.gov/catalog/nlm:nlmuid-2559001R-bk
[19] McIntosh, K. (1974). Coronaviruses: a comparative review. In Current Topics in Microbiology and Immunology/Ergebnisse der Mikrobiologie und Immunitätsforschung (pp. 85-129). Springer, Berlin, Heidelberg.
[20] URL (19-03-2020): https://www.the-scientist.com/foundations/the-rabies-vaccine-backstory-33441
[21] Carranza, F. (2013). Revolucionarios de la Ciencia. Badalona: Vergara Editores.
[22] El Principio de Precaución Pasivo, en contraste, podría entenderse como la invocación del Principio para no actuar.
[23] URL (14-03-2020): https://www.investigacionyciencia.es/revistas/investigacion-y-ciencia/aprender-mientras-dormimos-757/pasteur-el-cientfico-prudente-17058
[24] URL (14-03-2020): http://decs.bvs.br/cgi-bin/wxis1660.exe/decsserver/?IsisScript=../cgi-bin/decsserver/decsserver.xis&task=exact_term&previous_page=homepage&interface_language=e&search_language=e&search_exp=Protecci%F3n%20Cruzada
[25] Studzinski, C. M., Araujo, J. A., & Milgram, N. W. (2005). The canine model of human cognitive aging and dementia: pharmacological validity of the model for assessment of human cognitive-enhancing drugs. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 29(3), 489-498.
[26] Minchin, R. F., Johnston, M. R., Aiken, M. A., & Boyd, M. R. (1984). Pharmacokinetics of doxorubicin in isolated lung of dogs and humans perfused in vivo. Journal of Pharmacology and Experimental Therapeutics, 229(1), 193-198.; Atherton, M. J., Morris, J. S., McDermott, M. R., & Lichty, B. D. (2016). Cancer immunology and canine malignant melanoma: A comparative review. Veterinary immunology and immunopathology, 169, 15-26.
[27] Parkinson, J., Visser, S. A., Jarvis, P., Pollard, C., Valentin, J. P., Yates, J. W., & Ewart, L. (2013). Translational pharmacokinetic–pharmacodynamic modeling of QTc effects in dog and human. Journal of pharmacological and toxicological methods, 68(3), 357-366.
[28] Ekerot, P., Ferguson, D., Glämsta, E. L., Nilsson, L. B., Andersson, H., Rosqvist, S., & Visser, S. A. (2013). Systems pharmacology modeling of drug-induced modulation of thyroid hormones in dogs and translation to human. Pharmaceutical research, 30(6), 1513-1524.
[29] Meneguzzi, G. (2000). Inherited dystrophic epidermolysis bullosa in inbred dogs: a spontaneous animal model for somatic gene therapy. Journal of Investigative Dermatology, 115(1), 135-137.
[30] Redman, T. K., Rudolph, K., Barr, E. B., Bowen, L. E., Muggenburg, B. A., & Bice, D. E. (2001). Pulmonary immunity to ragweed in a beagle dog model of allergic asthma. Experimental lung research, 27(5), 433-451. & Warren, J., Nadel, M. K., Slater, E., & Millian, S. (1960). The canine distemper-measles complex. I. Immune response of dogs to canine distemper and measles viruses. American journal of veterinary research, 21, 111-119.
[31] Atienzar, F. A., Novik, E. I., Gerets, H. H., Parekh, A., Delatour, C., Cardenas, A., ... & Dhalluin, S. (2014). Predictivity of dog co-culture model, primary human hepatocytes and HepG2 cells for the detection of hepatotoxic drugs in humans. Toxicology and applied pharmacology, 275(1), 44-61.
[32] Marconato, L., Gelain, M. E., & Comazzi, S. (2013). The dog as a possible animal model for human non‐Hodgkin lymphoma: a review. Hematological oncology, 31(1), 1-9.
[33] Steinmetz, S., Tipold, A., & Löscher, W. (2013). Epilepsy after head injury in dogs: a natural model of posttraumatic epilepsy. Epilepsia, 54(4), 580-588.
[34] Authier, S., Legaspi, M., Gauvin, D., Chaurand, F., Fournier, S., & Troncy, E. (2008). Validation of respiratory safety pharmacology models: conscious and anesthetized beagle dogs. Journal of pharmacological and toxicological methods, 57(1), 52-60.
[35] El Etreby, M. F., & Gräf, K. J. (1979). Effect of contraceptive steroids on mammary gland of beagle dog and its relevance to human carcinogenicity. Pharmacology & Therapeutics, 5(1-3), 369-402.
[36] Kvetina, J., Svoboda, Z., Nobilis, M., Pastera, J., & Anzenbacher, P. (2000). Experimental Goettingen minipig and beagle dog as two species used in bioequivalence studies for clinical pharmacology (5-aminosalicylic acid and atenolol as model drugs). General physiology and biophysics, 18, 80-85.
[37] Loría-Cervera, E. N., & Andrade-Narváez, F. J. (2014). Animal models for the study of leishmaniasis immunology. Revista do Instituto de Medicina Tropical de São Paulo, 56(1), 1-11.
[38] Rojas, W., Anaya, J. M., Cano, L. E., Aristizábal, B. H., Gómez, L. M., & Lopera, D. (2015). Inmunología de Rojas. 17ma Ed. Medellín. Editorial Fondo CIB, p465-474.
[39] URL (16-03-2020): https://www.redaccionmedica.com/la-revista/noticias/coronavirus-historia-virus-familiar-conocido-en-el-3-300-a-c--9292
[40] Siddell, S. G., Anderson, R., Cavanagh, D., Fujiwara, K., Klenk, H. D., Macnaughton, M. R., & Van der Zeijst, B. A. M. (1983). Coronaviridae. Intervirology, 20(4), 181-189.
[41] Pedersen, N. C., Ward, J., & Mengeling, W. L. (1978). Antigenic relationship of the feline infectious peritonitis virus to coronaviruses of other species. Archives of virology, 58(1), 45-53.
[42] Fehr, A. R., & Perlman, S. (2015). Coronaviruses: an overview of their replication and pathogenesis. In Coronaviruses (pp. 1-23). Humana Press, New York, NY.
[43] Carrasco, L., & Almendral del Río, J. M. (2006). Virus patógenos. Madrid: Editorial Hélice.
[44] Sturman, L. S., Ricard, C. S., & Holmes, K. V. (1990). Conformational change of the coronavirus peplomer glycoprotein at pH 8.0 and 37 degrees C correlates with virus aggregation and virus-induced cell fusion. Journal of virology, 64(6), 3042-3050.
[45] Biberstein, E. L., Ramis Verges, M., & Zee, Y. C. (1994). Tratado de microbiología veterinaria. Zaragoza: Acribia.
[46] Sturman, L. S., & Holmes, K. V. (1983). The molecular biology of coronaviruses. In Advances in virus research (Vol. 28, pp. 35-112). Academic Press.
[47] Thevarajan, I., Nguyen, T. H., Koutsakos, M., Druce, J., Caly, L., van de Sandt, C. E., & Tong, S. Y. (2020). Breadth of concomitant immune responses prior to patient recovery: a case report of non-severe COVID-19. Nature Medicine, 1-3.
[48] HAELTERMAN, E.O. (1962). Epidemiological studies of transmissible gastroenteritis of swine. Proc. Ann.
Meet. U.S. Liverstock Sanit. Assoc., 86: 305—315.
[49] URL (19-03-2020): https://www.lavanguardia.com/vida/20200220/473668091793/coronavirus-transmision-fecal-contagio-heces.html
[50] Calvo, M., & del Mar, M. (2002). Coronavirus canino: identificación en España. Desarrollo de técnicas para el diagnóstico e inmunización. Madrid: Universidad Complutense de Madrid, Servicio de Publicaciones.
[51] URL (19-03-2020): https://www.who.int/es/emergencies/diseases/novel-coronavirus-2019/advice-for-public/q-a-coronaviruses : https://www.elmundo.es/ciencia-y-salud/salud/2020/03/10/5e677bfdfdddff2b9e8b4577.html
[52] Keenan, K.P., Jervis, H.R., Marchwicki, R.H., Binn, L.N. (1976). Intestinal infection of neonatal dogs with canine coronavirus 1—71: studies by virologic, histologic, histochemical, and immunofluorescent techniques. Am. J. Vet. Res., 37 (3): 247—256.
[53] De Groot, R. J., Lenstra, J. A., Luytjes, W., Niesters, H. G. M., Horzinek, M. C., Van der Zeijst, B. A. M., & Spaan, W. J. M. (1987). Sequence and structure of the coronavirus peplomer protein. In Coronaviruses (pp. 31-38). Boston: Springer.
[54] Sun, Z. F., & Meng, X. J. (2004). Antigenic cross-reactivity between the nucleocapsid protein of severe acute respiratory syndrome (SARS) coronavirus and polyclonal antisera of antigenic group I animal coronaviruses: implication for SARS diagnosis. Journal of clinical microbiology, 42(5), 2351-2352.
[55] Ksiazek, T. G., Erdman, D., Goldsmith, C. S., Zaki, S. R., Peret, T., Emery, S., & Rollin, P. E. (2003). A novel coronavirus associated with severe acute respiratory syndrome. New England journal of medicine, 348(20), 1953-1966.
[56] Takano, T., Satomi, Y., Oyama, Y., Doki, T., & Hohdatsu, T. (2016). Differential effect of cholesterol on type I and II feline coronavirus infection. Archives of virology, 161(1), 125-133.
[57] Glende J, Schwegmann-Wessels C, Al-Falah M, Pfefferle S, Qu X, Deng H, Drosten C, Naim HY, Herrler G (2008) Importance of cholesterol-rich membrane microdomains in the interaction of the S protein of SARS-coronavirus with the cellular receptor angiotensin-converting enzyme 2. Virology 381:215–221
[58] The cholesterol transport inhibitor U18666A inhibits type I feline coronavirus infection.
Takano T, Endoh M, Fukatsu H, Sakurada H, Doki T, Hohdatsu T
Antiviral Res. 2017 Sep; 145():96-102.
[59] Strating, J. R., van der Linden, L., Albulescu, L., Bigay, J., Arita, M., Delang, L., & Ulferts, R. (2015). Itraconazole inhibits enterovirus replication by targeting the oxysterol-binding protein. Cell reports, 10(4), 600-615.
[60] Williams, G. (2011). Dr Jenner's House: the birthplace of vaccination. The Lancet, 378(9788), 307-308.