Comunidades microbianas: los malos, los buenos y… la presión de los antibióticos
Por:Ximena Serrano Gil
Foto:Fotos 123 RF, Milagro Castro DOI https://doi.org/10.12804/dvcn_10336.37644_num6
Salud y bienestar
Por:Ximena Serrano Gil
Foto:Fotos 123 RF, Milagro Castro DOI https://doi.org/10.12804/dvcn_10336.37644_num6
Las infecciones asociadas a bacterias intestinales son un gran problema en todo el mundo, pues favorecen el desarrollo de enfermedades que ponen en riesgo la vida de las personas y los animales. Desde la Universidad del Rosario, la doctora en Biotecnología Marina Muñoz Díaz lidera estudios dirigidos a la detección y caracterización de bacterias patógenas, que causan un efecto nocivo sobre el bienestar de un individuo, y pueden ocasionar cambios en las comunidades microbianas. Los trabajos de Muñoz, en conjunto con investigadores del Centro de Investigación en Microbiología y Biotecnología de la Universidad del Rosario (Cimbiur) de la Facultad de Ciencias Naturales, del cual es directora técnica, son pioneros en Latinoamérica.
Identificar la diversidad de las especies que colonizan el organismo (microbiota) y que compiten, cooperan e interactuan entre ellas es esencial para asegurar la efectividad de los tratamientos existentes para combatirlos.
Sobre este particular, la investigadora explica que “lo que es transversal en las investigaciones de microorganismos, son las herramientas de biología molecular y de secuenciación de última generación, las cuales permiten conocer las bases genéticas que modulan el efecto de las especies microbianas (bacterias, hongos, parásitos y virus) sobre hospederos y ambientes. Esta interacción produce efectos tanto beneficiosos como dañinos, para la salud humana, animal y ambiental”.
“Mi investigación se dirige inicialmente a la caracterización de `los malos del paseo´, los patógenos; una vez conozcamos estas bases genéticas podremos generar soluciones a problemas graves de salud”, comenta Muñoz.
Esta caracterización es única para cada paciente y permite construir un mapa que sirve como referencia. No obstante, es necesario que con cierta periodicidad se repita la descripción, pues los microorganismos cambian, es decir, ganan y pierden material genético.
Por ejemplo: “Podemos tener Escherichia coli, una bacteria común en la microbiota intestinal. Sin embargo, algunas poblaciones de esta especie son malas (patógenas) y si estas tienen la oportunidad de multiplicarse, pueden causar problemas serios. Si, además, son resistentes a los antibióticos, un tratamiento que antes era efectivo ahora deja de serlo y, por ende, la condición clínica del paciente puede complicarse hasta encontrar una alternativa que sea realmente eficaz. Por ello es tan importante hacer esta caracterización de ‘los malos’”, agrega la investigadora.
Con las herramientas que utiliza el Cimbiur se pueden identificar la presencia del microorganismo y los marcadores moleculares de interés para la salud, como los relacionados con la resistencia a antibióticos, lo que aporta una información muy útil para el manejo de los pacientes.
Los trabajos más relevantes de la investigadora se dirigen a la caracterización de bacterias como: Clostridiodes difficile (causante de diarrea y colitis), Clostridium perfringens (común en las intoxicaciones alimentarias), enterobacterias productoras de carbapenemasas (EPC) y otras que impactan severamente el entorno intrahospitalario y de la comunidad en general.
Por otra parte, puntualiza Muñoz, “casi nunca nos preocupamos por la parte benéfica, ni mucho menos se considera una visión holística del ecosistema intestinal, un abordaje fundamental para dimensionar los efectos que se producen. Este análisis de la presencia y las interacciones de microorganismos patógenos, entre ellos junto con todo el material genético de la microbiota (el microbioma), es muy importante para conocer sobre la ecología microbiana”.
“Es importante darle una aplicación a toda esa información. De ahí que desde el Cimbiur tenemos proyectado obtener productos con potencial biotecnológico, como pruebas diagnósticas, esquemas de vigilancia e incluso probióticos, para transferir el conocimiento. Es fundamental que desde la ciencia podamos impactar positivamente a las personas, mediante la generación de soluciones a problemas de la comunidad general”, comenta la profesora Muñoz.
La resistencia a los antibióticos es una de las principales causas de muerte en todo el mundo. Más de 1,2 millones de personas murieron en 2019 como resultado directo de infecciones bacterianas resistentes a antibióticos, según un estudio adelantado en 204 países, publicado por la revista The Lancet.
Si bien los antibióticos han sido diseñados para curar y salvar vidas, también pueden causar efectos adversos al eliminar las bacterias intestinales benéficas encargadas de mantener el equilibrio del sistema gastrointestinal. Además, pueden generar una presión de selección que hace que las poblaciones resistentes, las que tienen marcadores moleculares que les confiere resistencia, proliferen. En esa circunstancia, las bacterias proliferan e invaden el organismo.

“Mi investigación se dirige inicialmente a la caracterización de `los malos del paseo´, los patógenos; una vez conozcamos las bases genéticas que soportan su efecto podremos generar soluciones a problemas graves de salud”, comenta la doctora en Biotecnología Marina Muñoz Díaz, quien desde la Universidad del Rosario lidera varios estudios dirigidos a la detección y caracterización de las bacterias patógenas.
La comunidad científica está advirtiendo que la resistencia bacteriana frente a los antibióticos puede ser la próxima pandemia. En el artículo Composición de la microbiota intestinal en pacientes con diarrea adquirida en centros de salud y en la comunidad con infección por Clostridioides difficile, publicado en 2021 en la revista Scientific Reports de la casa editorial Nature, los profesores Marina Muñoz y Juan David Ramírez, junto a otros investigadores, indican que “una de las infecciones de mayor impacto mundial es la Infección por C. difficile (ICD), considerada como el agente causal de la diarrea asociada al uso de antibióticos”.
Esta bacteria puede detonar una variedad de problemas leves, como diarrea y enfermedad inflamatoria intestinal, hasta complicaciones graves del tracto digestivo, como megacolon tóxico, colitis pseudomembranosa y sepsis, cuadros estos que conllevan un alto riesgo mortalidad. Los problemas asociados a la ICD empeoran, principalmente, en pacientes con estancias hospitalarias en las unidades de cuidados intensivos (UCI), desde donde se reporta como una de las cinco infecciones con mayor impacto a nivel mundial.
Estas alteraciones están relacionadas con el uso indiscriminado o equivocado de antibióticos que expone el organismo a un estímulo que afecta a las comunidades microbianas; por lo tanto, las bacterias con la capacidad de resistir a antibióticos son las que proliferan, colonizando el microambiente intestinal. En palabras de Muñoz, “estamos atacando nuestro organismo en doble sentido, es decir atacando la microbiota benéfica y favoreciendo al patógeno. En definitiva, estamos rompiendo el balance intestinal”.
Las UCI son lugares donde los pacientes reciben altas dosis de antibióticos que ocasionan desequilibrio de las comunidades microbianas, lo cual, sumado a cuadros de inmunosupresión bien sea por la existencia de enfermedades o por la aplicación de tratamientos, hace que estos pacientes sean más susceptibles de sufrir complicaciones como la ICD. “Es el medio perfecto para que bacterias patógenas puedan multiplicarse, colonizar y dañar el equilibrio de la microbiota intestinal, lo que se asocia, entre otras cosas, con la mala absorción de nutrientes y el debilitamiento del sistema inmunitario”, indica Muñoz. Por esta razón dicha población es de tanto interés para el Centro de Investigación, cuyos integrantes también están desarrollando un proyecto colaborativo con el Hospital Universitario Mayor Méderi de Bogotá, que busca describir el metagenoma intestinal en pacientes en UCI.
En el estudio de Scientific Reports se describieron los cambios en las comunidades microbianas en pacientes con C. difficile. Ahora en el hospital se está buscando todo el material genético, conocido como metagenoma, para conocer a fondo lo que está sucediendo con los pacientes a nivel intrahospitalario.
La bióloga Muñoz añade que en los estudios previos han encontrado que hay una alta frecuencia de infección tanto en el contexto intrahospitalario como en el de la comunidad en general, y que gracias a las técnicas moleculares encontraron que en el primer entorno más del 58 por ciento de las personas tienen ese microorganismo (C. difficile), mientras que en la comunidad, en el 38 por ciento de la población, aproximadamente. Dependiendo de los factores de riesgo de cada persona, puede tener lugar un desenlace clínico complejo.
La diversidad microbiana del país no ha sido muy estudiada. Generalmente se habla de diversidad de plantas y animales, pero no de microorganismos, los cuales son aún más diversos. “Nuestro Centro de Investigación está describiendo la diversidad microbiana y reportándola en bases de datos internacionales porque necesitamos que el mundo la conozca para generar estrategias de comparación más precisas. Esta investigación es pionera en Colombia”, enfatiza Muñoz.
De acuerdo con la bióloga, las investigaciones en C. difficile realizadas en países como Estados Unidos e Inglaterra reportan que las poblaciones de los microorganismos son muy conservadas, es decir que son similares entre ellas, y la diversidad se había limitado solo a unos cuantos “clados” (conjunto de especies con un antepasado común). La investigación en Colombia, al contrario, encontró que hay una alta diversidad y que existen más poblaciones de estos microorganismos que las reportadas anteriormente.
Al estudiar los marcadores moleculares (pequeñas ventanas dentro del genoma), y al observar que había organizaciones diferentes, los investigadores decidieron analizar el genoma completo. El Centro de Investigación también es pionero en el “estudio de la epidemiología genómica”, que permite profundizar en cómo está organizado el genoma humano y a la vez hacer estudios robustos sobre poblaciones de microorganismos.
El siguiente paso en la investigación fue estudiar si la población microbiana de los pacientes hospitalarios correspondía a la misma que se encontraba en la comunidad (fuera del hospital). La herramienta permitió determinar que solo una de dichas poblaciones era compartida.
Estos microbiomas presentes dentro y fuera de las UCI funcionan con una estructura diferente a nivel del genoma, incluso en los genes codificados para las toxinas; también en los marcadores de resistencia a los antibióticos. Todo ello, en conjunto, puede elevar la complejidad en el manejo clínico de los pacientes infectados, lo que no se había estudiado antes en Colombia.
“Si los médicos tuvieran acceso a los resultados de este tipo de herramientas para cada paciente podrían, de manera más fácil, seleccionar y formular el tratamiento más eficaz. Estas herramientas sirven, además, para conocer los patrones de dispersión de esos microorganismos y para descubrir cómo llegan a los diferentes territorios o hasta cómo se dispersan dentro de un hospital”, subraya Muñoz.
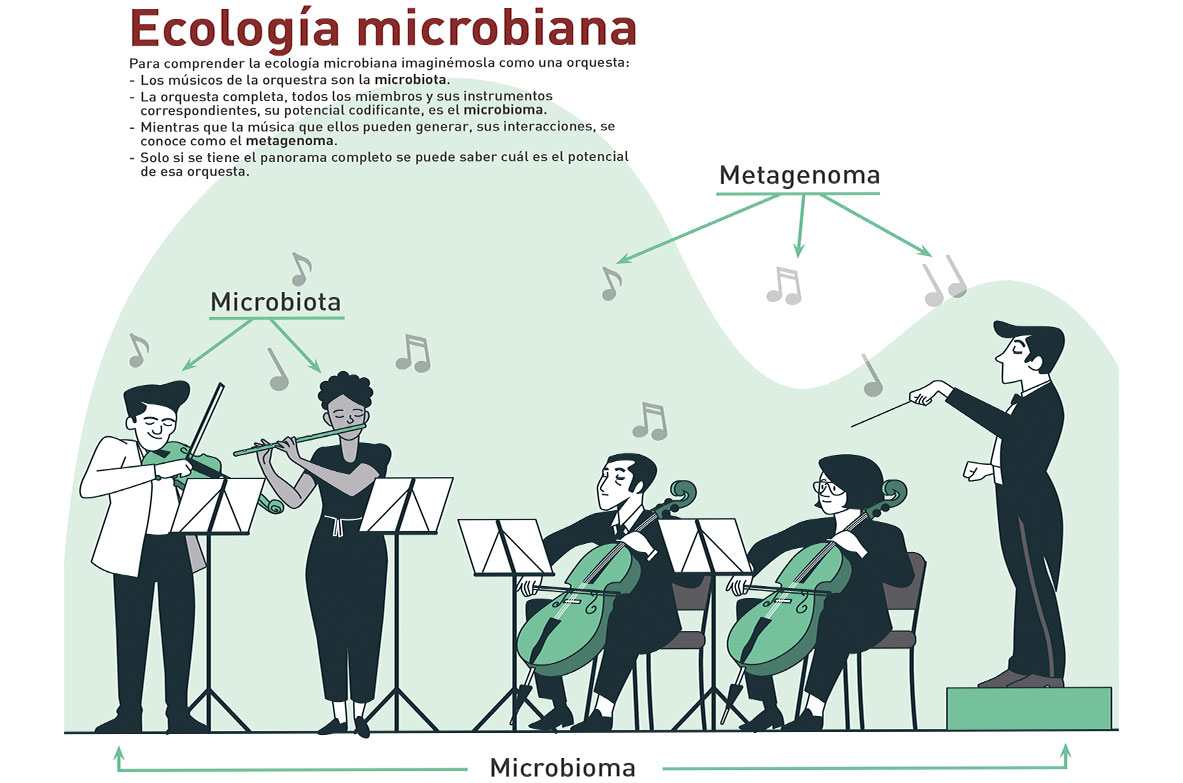
Para comprender la ecología microbiana imaginémosla como una orquesta:
- Los músicos de la orquestra son la microbiota.
- La orquesta completa, todos los miembros y sus instrumentos correspondientes, su potencial codificante, es el microbioma.
- Mientras que la música que ellos pueden generar, sus interacciones, se conoce como el metagenoma.
- Solo si se tiene el panorama completo se puede saber cuál es el potencial de esa orquesta.
Microbiota: Conjunto de microorganismos que se encuentran en un ambiente (piel, mucosas, etc.). Los microorganismos residen en estos lugares de forma más o menos permanente y en algunos casos realizan funciones específicas.
Microbioma: Hace referencia a los microorganismos presentes en un entorno específico, incluyendo todo el material genético allí presente. Este conjunto forma un microecosistema dinámico e interactivo.
Metagenoma: Conjunto de genes microbianos presentes en un entorno o ecosistema determinado. La metagnómica reúne las técnicas que se utilizan para estudiar todo este conjunto sin necesidad de aislar cada una de las poblaciones encontradas.
Clostridioides difficile es una bacteria grampositiva, anaerobia, que se reproduce mediante esporas, las cuales son resistentes y pueden estar en alimentos o agua contaminados. El consumo de esas esporas permite que el microorganismo llegue hasta el intestino donde produce un arsenal de toxinas que son las causantes de las enfermedades asociadas. Las esporas son expulsadas a través de las heces y son altamente resistentes, incluso al hipoclorito de sodio, por lo que se sugiere la descontaminación exhaustiva de vegetales de forma manual.
Niveles de infección
Pacientes asintomáticos.
Pacientes con diarrea. Colitis simple.
Todo lo anterior corresponde a la parte manejable de la infección, pero cuando se suman otras variables, como el uso indiscriminado de antibióticos, la existencia de otras enfermedades y el inmunocompromiso del paciente estas agudizan el impacto de los microorganismos, lo que puede ocasionar:
Colitis pseudomembranosa.
Colitis fulminante/megacolon tóxico.
Muerte del paciente